L'immunothérapie : quand l'organisme devient une arme de destruction massive
L'immunothérapie anticancéreuse a pour principe d'utiliser le système immunitaire du patient comme arme de destruction tumorale. Si le concept a été élaboré il y a plus d'un siècle, les réelles applications thérapeutiques ont vraiment émergé il y a une dizaine d'années et ont été couronnées par l'attribution du prix Nobel de médecine en 2018 (James P. Allison & Tasuku Honjo). Actuellement plus de 1 300 essais cliniques utilisant des approches immunothérapeutiques sont en cours et les premiers produits issus de ce concept ont été enregistrés et commercialisés.
Deux grandes approches d'immunothérapie sont actuellement développées et sont le fruit de la convergence des découvertes des mécanismes de régulation du système immunitaire humain, de la biologie des tumeurs et de la création de nouveaux outils moléculaires afin d'éditer et de manipuler plus aisément l'information génétique.
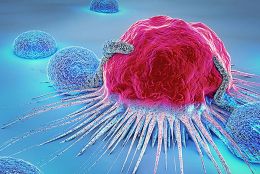
L'approche des inhibiteurs de points de contrôle du système immunitaire utilise des anticorps pour déverrouiller les freins créés par les tumeurs afin d'échapper au système immunitaire. Les premiers produits ont été commercialisés dans les années 2010 (ipilimumab et nivolumab développés et commercialisés par BMS sous le nom de Yervoy et OPDIVO respectivement) suite à une efficacité remarquable démontrée lors des essais cliniques sur des cas avancés de mélanome. Depuis, ces deux produits en monothérapie ou en combinaison ont trouvé de nombreuses autres indications transformant l'approche en une approche antitumorale plus large comme en témoignent les nombreux essais cliniques en cours.
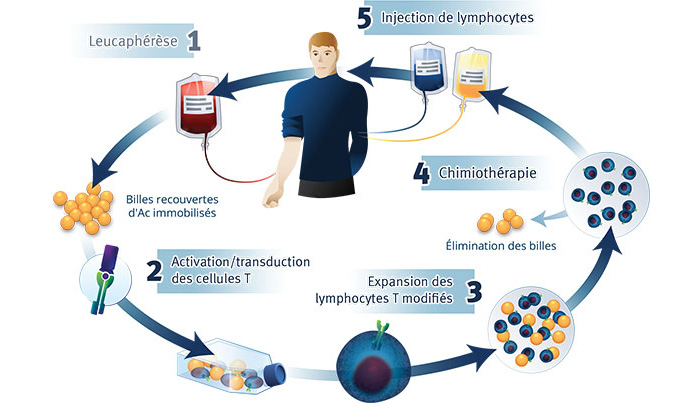
L'approche des cellules T-CAR est certainement la plus complexe mais la plus versatile des approches d'immunothérapie. Elle consiste à prélever des lymphocytes T de patients cancéreux, à les modifier génétiquement in vitro afin de leur apporter des caractéristiques de cellules tueuses antitumorales et in fine les réinjecter afin qu'ils puissent reconnaître la tumeur et induire une très forte réponse immunitaire contre celle-ci. Si l'efficacité clinique de cette approche a été démontrée et souvent de manière spectaculaire, elle est pour l'instant cantonnée aux tumeurs liquides (cancers du sang) plus faciles d'accès en comparaison des tumeurs solides. Contrairement aux deux premières approches, l'approche T-CAR demeure une approche individuelle de par l'utilisation de lymphocytes provenant du patient sous traitement. Les prochaines améliorations devront permettre de développer des lymphocytes allogéniques, issus d'un seul et même donneur, afin de limiter le temps de traitement. La France se distingue sur ce point avec la société Cellectis pionnière de l'approche T-CAR allogénique.
Si l'immunothérapie porte de grands espoirs pour de nombreux cancers, le fait de modifier/bouleverser le système immunitaire tend à créer des effets secondaires qui peuvent être sévères. D'autre part, la réponse des patients semble extrêmement diverse face à ce type d'approche en monothérapie, et la combinaison avec les inhibiteurs de points de contrôle est désormais le mot d'ordre allié à un diagnostic précis de l'état immunitaire du patient.
Les nanotechnologies au cœur de la tumeur
Les applications des nanotechnologies en santé sont rendues possibles grâce à l'exploitation des propriétés physiques, chimiques et biologiques des matériaux à l'échelle nanométrique. Les nanotechnologies ont désormais leur place dans l'arsenal antitumoral, elles sont utilisées aussi bien dans la construction d'édifice moléculaire afin de cibler les cellules cancéreuses de manière spécifique ou comme amplificateur de traitements radiothérapiques.
Le ciblage des cellules cancéreuses est certainement l'enjeu le plus crucial afin de limiter les effets secondaires. En effet, concentrer le traitement sur les cellules cancéreuses est un élément déterminant afin de limiter les effets secondaires et d'augmenter l'efficacité du traitement. Cibler spécifiquement une cellule cancéreuse demande l'addition de plusieurs entités moléculaires à même de se fixer sur la cellule malade et de provoquer sa mort. Les nanoparticules permettent de construire des édifices moléculaires complexes en jouant un rôle de liant central de la structure.
La radiothérapie fait également appel aux nanotechnologies afin d'amplifier l'action des rayons X au niveau des tumeurs. La société française Nanobiotix a par exemple développé des nanoparticules capables de concentrer l'absorption des rayons X à l'intérieur des cellules cancéreuses. Leur produit phare a été enregistré récemment en Europe dans le sarcome des tissus mous. L'approche, compatible avec les protocoles de radiothérapie standards, affiche un potentiel thérapeutique très large. De son côté la société NH TherAguix, intégrée au programme Hub Healthtech de BPI France, développe une solution nanométrique couplant diagnostic et thérapie. Cette approche innovante, dont les données de phase II seront disponibles fin 2020, permet un traitement spécifique des métastases cérébrales.
Le renouveau d'une approche centenaire : la radiothérapie
La radiothérapie est l'un des piliers de la prise en charge du cancer. Si elle continue de représenter une arme efficace, grâce notamment à une amélioration incrémentale des protocoles et de la précision des faisceaux, celle-ci connaît depuis quelques années de nouvelles avancées prometteuses afin de répondre à deux grands enjeux : la radiorésistance de certaines tumeurs et les effets secondaires à long terme.
L'association de l'imagerie médicale, de l'informatique et de la radiothérapie permet des traitements de plus en plus précis avec un ciblage en trois dimensions (radiothérapie stéréotaxique) ou même en quatre dimensions avec la radiothérapie désormais asservie à la respiration dans le cas des cancers pulmonaires.
Des approches utilisant des rayonnements autres que les rayons X font également leur apparition, avec de nouvelles particules comme les protons ou les ions carbones. La protonthérapie permet un ciblage beaucoup plus précis que les rayons X du fait d'un comportement physique particulier (pic de Bragg) permettant de déposer l'essentiel de leur énergie au niveau des cellules tumorales. Environ une centaine de centres de protonthérapie sont désormais fonctionnels ou en construction dans le monde. Leur déploiement est toutefois relativement lent compte tenu d'un investissement initial élevé lié à la présence d'un accélérateur de particules de type cyclotron couplé aux chambres de traitement.
La protonthérapie
Les indications prioritaires sont les cancers tête/cou difficiles d'accès chirurgicalement et les cancers pédiatriques où la préservation des tissus sains toujours en développement est un enjeu majeur. D'autres types de faisceaux sont également en développement comme les ions carbone dans le cas d'essai de carbonethérapie. Encore au stade de la recherche clinique, cette approche semble plus précise et efficace que l'approche protonthérapique, et utilisable notamment pour les cancers radiorésistants, mais les investissements par site demeurent rédhibitoires.
L'IA pour une approche personnalisée du traitement du cancer
La complexité de l'oncologie, fruit de la diversité des cancers, de la multiplicité des protocoles et des pratiques, du foisonnement incessant des essais cliniques ou des publications scientifiques, fait de cette spécialité médicale un terrain évident pour l'intelligence artificielle (IA) couplée au Big Data.
L'IA est la seule désormais capable d'embrasser entièrement l'immense complexité des données de santé (images, séquence génomique, constantes physiologiques, protocoles, comptes-rendus de visite, données de vie réelle, etc.) du dossier médical d'un patient atteint d'un cancer. Le rapprochement intelligent de ces données permet de mieux diagnostiquer, d'adapter précisément le traitement au patient et de déterminer les risques de récidive.
L'IA est désormais engagée sur toute la chaîne de valeur du développement d'un médicament anticancéreux. La découverte de nouvelles molécules thérapeutiques, de nouveaux protocoles thérapeutiques ou de nouvelles indications pour des traitements existants profitent grandement de l'apport de l'analyse globale des données de santé. Celle-ci permet la mise à jour de nouvelles relations entre gènes, médicaments et maladies dans un temps et une exhaustivité qui n'est pas à la portée d'une équipe clinique ou de recherche.
Les essais cliniques en oncologie qui permettent de démontrer l'efficacité d'un traitement avant sa commercialisation sont longs et extrêmement coûteux du fait notamment de l'hétérogénéité des cohortes de patients. L'IA peut participer à la qualification des patients traités et à l'analyse de la masse de données de suivi permettant une forte augmentation de la probabilité de réussite des essais.
Toutes ces avancées ne seront possibles qu'avec un cadre technico-juridique approprié alliant confidentialité, consentement éclairé des patients, structuration des données et interopérabilité des systèmes d'information. Ce cadre doit être encore précisé afin d'intensifier l'utilisation massive des données de santé dans une logique de véritable personnalisation de l'approche anticancéreuse.